
بیماری پارکینسون
بیماری پارکینسون (PD) یک اختلال پیشرونده است که بر سلول های عصبی مغز که مسئول حرکت بدن هستند تأثیر می گذارد. وقتی نورون های تولید کننده دوپامین می میرند ، علائمی مانند لرزش ، کندی ، سفتی و مشکلات تعادلی ایجاد می شود. درمان شامل داروها ، رژیم غذایی ، ورزش و جراحی تحریک مغزی عمیق است و بر روی کاهش علائم بیماری تمرکز می کند تا شیوه زندگی فعال تری ایجاد شود.
سیستم عصبی و دوپامین
برای درک پارکینسون ، درک نحوه عملکرد نورون ها و تأثیر PD بر مغز مفید است.
سلولهای عصبی یا نورونها مسئول ارسال و دریافت پالس ها یا پیامهای عصبی بین بدن و مغز هستند. سیم کشی برق خانه خود را تصور کنید. یک مدار الکتریکی از سیمهای متعددی تشکیل شده است که به گونه ای به هم متصل شده اند که وقتی کلید زده می شود ، یک لامپ روشن می شود. به طور مشابه ، عصبی که برانگیخته شده است ، انرژی خود را به نورون های کناری خود منتقل می کند.
سلولهای عصبی دارای جسم سلولی با بازوهای منشعب به نام دندریت هستند که مانند آنتن عمل کرده و پیامها را دریافت می کنند. آکسون ها پیام ها را از جسم سلولی منتقل می کنند. مسیر پالس ها از نرون به نرون ، از آکسون یک سلول به دندریت های سلول دیگر و عبور از فاصله کوچک بین دو سلول عصبی به نام سیناپس، می گذرد. پیام رسان های شیمیایی که انتقال دهنده های عصبی یا نروترنسمیتر نام دارند به پالس الکتریکی اجازه می دهند از این فاصله عبور کند.
نورون ها به روش زیر با یکدیگر صحبت می کنند (شکل ۱):
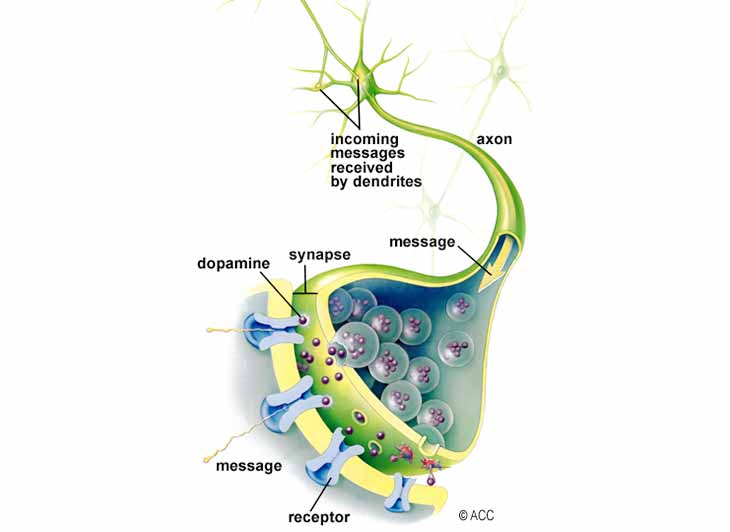
شکل ۱ – نورونها از طریق یک شکاف کوچک به نام سیناپس با یکدیگر ارتباط برقرار می کنند. پیامهای ورودی از مرکز تصویر به آکسون منتقل می شود که در آن سلول عصبی تحریک می شود تا نروترنسمیترها را در سیناپس آزاد کند. گیرنده های سلول عصبی مجاور، این پیام رسان های شیمیایی را گرفته و پیام را به طور موثر به سلول عصبی بعدی منتقل می کنند.
- پیام های ورودی از دندریت ها به انتهای آکسون منتقل می شود ، جایی که کیسه های حاوی نروترنسمیترها (دوپامین) در داخل سیناپس باز می شوند.
- مولکول های دوپامین از سیناپس عبور کرده و بر روی گیرنده های خاصی در سلول گیرنده قرار می گیرند.
- آن سلول تحریک می شود تا پیام را منتقل کند.
- پس از انتقال پیام ، گیرنده ها مولکول های دوپامین را به سیناپس باز می گردانند ، جایی که دوپامین اضافی “جذب” شده یا در نورون رها شده، بازیافت می شود.
- مواد شیمیایی موسوم به MAO-B و COMT دوپامین باقی مانده را تجزیه می کنند به طوری که ناحیه سیناپس “تمیز” و برای پیام بعدی آماده باشد.
بیماری پارکینسون چیست؟
بیماری پارکینسون (PD) یک اختلال دژنراتیو پیشرونده است که بر سلول های عصبی در قسمت های عمیق مغز به نام گانگلیون های پایه و جسم سیاه تأثیر می گذارد. سلولهای عصبی در توده سیاه ، نروترنسمیتر دوپامین را تولید می کنند و مسئول انتقال پیامهایی هستند که حرکت بدن را برنامه ریزی و کنترل می کنند. به دلایلی که هنوز درک نشده است ، سلول های عصبی تولید کننده دوپامین در جسم سیاه در برخی از افراد شروع به مردن می کنند. هنگامی که ۸۰ درصد دوپامین از بین برود ، علائم پارکینسون مانند لرزش ، کندی حرکت ، سفتی و مشکلات تعادلی مشاهده می شوند.
حرکت بدن توسط زنجیره پیچیده ای از تصمیمات شامل گروه های به هم پیوسته سلول های عصبی به نام گانگلیون کنترل می شود. اطلاعات به ناحیه مرکزی مغز به نام جسم مخطط می رسد ، که با جسم سیاه همکاری می کند و پالس ها را از نخاع به مغز و برعکس می فرستد. گانگلیون های پایه و مخچه وظیفه اطمینان از روان بودن فرایند انجام حرکت را بر عهده دارند (شکل ۲).
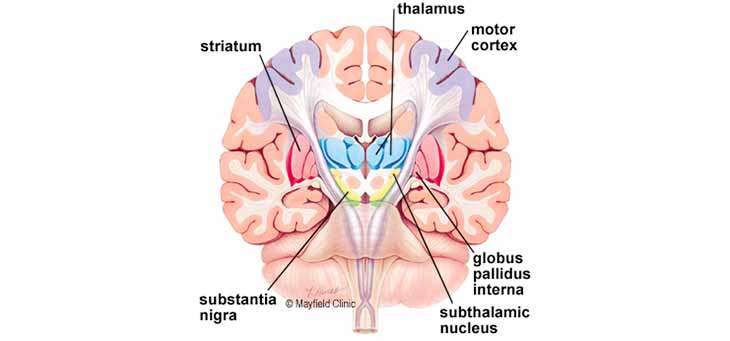
شکل ۲. تصویر مقطعی از مغز. پیام حرکت بدن از کرتکس حرکتی مغز شروع می شود. گانگلیون های پایه مسئول فعال سازی یا ایجاد مدارهای مخصوص یا حلقه های بازخورد هستند.
این تکانه ها از نورون به نورون منتقل می شوند و به سرعت از مغز به نخاع و در نهایت به عضلات منتقل می شوند. هنگامی که گیرنده های دوپامین در جسم مخطط به میزان کافی تحریک نشوند ، بخش هایی از گانگلیون های پایه نیز کمتر یا بیش از حد تحریک می شوند. به طور خاص ، هسته ساب تالاموس (STN) بیش از حد فعال می شود و به عنوان ترمزی عمل می کند که باعث تعلیق حرکت و سفتی می شود. هنگامی که تحریک بیش از حد باشد، تأثیر زیادی بر تالاموس می گذارد ، که به نوبه خود خروجی تالاموس را کاهش داده و باعث رعشه می شود (شکل ۳).
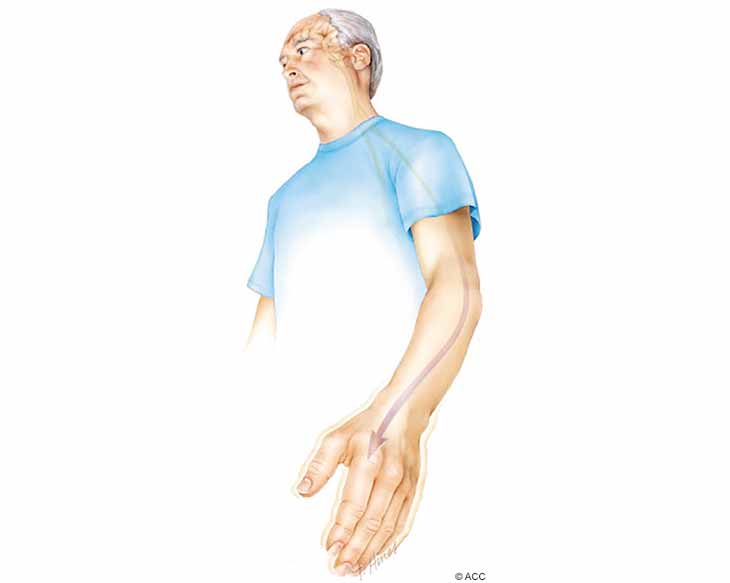
شکل ۳. هنگامی که گانگلیون های پایه بیش از حد یا کمتر تحریک می شوند علائم لرزش ، سفتی و کندی حرکت رخ می دهد.
عملکرد دوپامین با انتقال دهنده عصبی دیگری به نام استیل کولین مخالف است. در پارکینسون سلولهای عصبی تولید کننده دوپامین در حال از بین رفتن هستند. علائم پارکینسون، شامل لرزش و سفتی زمانی رخ می دهند که سلول های عصبی فرایند را شروع می کنند ولی دوپامین کافی برای انتقال پیام ها وجود ندارد. همچنین در پارکینسون سطوح بالای گلوتامات ، یک نروترنسمیتر دیگر نیز ظاهر می شود زیرا بدن سعی می کند کمبود دوپامین را جبران کند.
علت بیماری پارکینسون
همانطور که در بالا شرح داده شد، در بیماری پارکینسون ، نورون ها در مغز به تدریج تجزیه شده یا می میرند. بسیاری از علائم بیماری ناشی از از دست دادن سلول های عصبی است که پیام رسان شیمیایی به نام دوپامین در مغز انسان تولید می کند. هنگامی که سطح دوپامین در بدن کاهش می یابد ، باعث فعالیت غیر طبیعی مغز می شود که منجر به اختلال در حرکت و سایر علائم بیماری پارکینسون می شود.
علت بیماری پارکینسون ناشناخته است ، اما به نظر می رسد عوامل متعددی در بروز آن نقش دارند ، از جمله:
ژن ها. محققان جهش های ژنتیکی خاصی را شناسایی کرده اند که می تواند باعث بیماری پارکینسون شود. اما این موارد به طور معمول اتفاق نمی افتند ، مگر در موارد نادری که بسیاری از اعضای خانواده به بیماری پارکینسون مبتلا هستند.
با این حال ، به نظر می رسد که تغییرات ژنی خاصی خطر ابتلا به بیماری پارکینسون را افزایش می دهند ، اما برای هر یک از این نشانگرهای ژنتیکی احتمال ابتلا به بیماری پارکینسون بسیار کم است.
عوامل محرک محیطی. قرار گرفتن در معرض برخی سموم یا عوامل محیطی ممکن است خطر ابتلا به بیماری پارکینسون بعدی را افزایش دهد ، اما خطر نسبتاً کمی است.
محققان همچنین اشاره کرده اند که تغییرات زیادی در مغز افراد مبتلا به بیماری پارکینسون رخ می دهد ، اگرچه دلیل این تغییرات مشخص نیست. این تغییرات عبارتند از:
حضور اجساد Lewy. تجمع مواد خاصی در سلول های مغزی، نشانگرهای میکروسکوپی بیماری پارکینسون هستند. به این اجسام لوی گفته می شود و محققان معتقدند این اجسام لوی سرنخ مهمی برای علت بیماری پارکینسون هستند.
آلفا سینوکلئین یافت شده در جسم لوی. اگرچه مواد زیادی در جسم لوی یافت می شود ، اما دانشمندان معتقدند که یکی از مهم ترین ها، پروتئین طبیعی و گسترده به نام آلفا سینوکلئین (a-synuclein) است. این پروتئین در همه جسم های لوی به شکل توده ای یافت می شود که سلول ها نمی توانند آن را تجزیه کنند. در حال حاضر در میان محققان بیماری پارکینسون تمرکز زیادی بر این موضوع است.
عوامل خطر
عوامل خطر بیماری پارکینسون عبارتند از:
سن. افراد جوان به ندرت بیماری پارکینسون را تجربه می کنند. این بیماری معمولاً در اواسط یا اواخر زندگی شروع می شود و با افزایش سن ریسک آن افزایش می یابد. افراد معمولاً در حدود ۶۰ سالگی یا بالاتر به این بیماری مبتلا می شوند.
وراثت. داشتن خویشاوند نزدیک با بیماری پارکینسون احتمال ابتلا به این بیماری را افزایش می دهد. با این حال ، ریسک شما هنوز کم است مگر اینکه در خانواده خود بستگان زیادی با بیماری پارکینسون داشته باشید.
جنسیت. مردان بیشتر از زنان به بیماری پارکینسون مبتلا می شوند.
قرار گرفتن در معرض سموم. قرار گرفتن مداوم در برابر علف کش ها و آفت کش ها ممکن است کمی خطر ابتلا به بیماری پارکینسون را افزایش دهد.
علائم این بیماری چیست؟
علائم پارکینسون در افراد مختلف با توجه به میزان پیشرفت بیماری متفاوت است. فردی که مبتلا به پارکینسون است ممکن است برخی از این علائم “مشخصه” شایع تر را تجربه کند:
- برادی کینزی – کندی حرکت ، اختلال در مهارت و چابکی ، کاهش پلک زدن ، ریختن آب دهان ، صورت بدون حالت.
- رعشه در حالت استراحت – لرزش غیر ارادی که با حرکت هدفمند کاهش می یابد و به طور معمول از یک طرف بدن ، معمولاً دست شروع می شود.
- سفتی – سفتی ناشی از افزایش غیر ارادی تون عضلانی.
- بی ثباتی وضعیت بدنی – احساس عدم تعادل. بیماران اغلب با پایین آوردن مرکز ثقل خود ، که منجر به حالت خمیده می شود ، این حالت را جبران می کنند.
علائم دیگری که ممکن است ظاهر بشوند یا نشوند:
- خشک شدن ناگهانی یا گیر کردن درجا
- راه رفتن نا منظم یا کشیدن یک پا
- حالت خمیده
- دست خط ریز و درهم
- مشکلات خواب ، بی خوابی
- بی تفاوتی ، افسردگی
- کاهش حجم صدا یا لرزش هنگام صحبت کردن
- اختلال در بلع
- یبوست
- اختلال شناختی
علت بیماری پارکینسون چیست؟
علت این بمیاری تا حد زیادی ناشناخته است. دانشمندان در حال حاضر در حال بررسی نقش ژنتیک ، عوامل محیطی و روند طبیعی پیری در مرگ سلولی و پارکینسون هستند.
همچنین انواع ثانویه پارکینسون وجود دارند که ناشی از داروهایی مانند هالوپریدول (دارویی که برای درمان گیجی و توهم استفاده می شود) ، رزرپین (یکی از ترکیبات برخی داروهای ضد فشار خون بالا) و متوکلوپرامید (داروی ضد تهوع) می باشند.
چه کسی را درگیر می کند؟
بیش از ۱.۵ میلیون آمریکایی مبتلا به پارکینسون هستند. این بیماری معمولاً در مردان و زنان در حدود ۶۰ سالگی رخ می دهد. پارکینسون زودرس در حدود ۴۰ سالگی رخ می دهد.
چگونه تشخیص داده می شود؟
از آنجا که سایر بیماری ها و داروها هم علائمی مشابه پارکینسون دارند ، تشخیص دقیق توسط پزشک مهم است. هیچ آزمایش واحدی نمی تواند تشخیص پارکینسون را تأیید کند ، زیرا علائم در افراد مختلف متفاوت است. گرفتن شرح حال و معاینه فیزیکی کامل برای تشخیص مورد نیاز است. سایر بیماری هایی که علائم شبه پارکینسون دارند شامل پارکینسون پلاس ، لرزش اساسی ، فلج پیشرونده هسته ای ، آتروفی چند سیستم ، دیستونی و هیدروسفالی فشار معمولی، می باشند.
چه درمان هایی در دسترس است؟
بسیاری از بیماران مبتلا به پارکینسون از زندگی فعال و امید به زندگی طبیعی برخوردارند. حفظ سبک زندگی سالم با خوردن رژیم غذایی متعادل و فعال ماندن از نظر جسمانی به سلامت کلی فرد کمک می کند. بیماری پارکینسون با مراقبت از خود ، دارو و جراحی قابل کنترل است.
خود مراقبتی
ورزش به اندازه دارو در درمان پارکینسون مهم است. ورزش به حفظ انعطاف پذیری کمک می کند و تعادل و دامنه حرکتی را بهبود می بخشد. سلامت و آسایش خانواده و مراقبان نیز که با پارکینسون مقابله می کنند به همان اندازه مهم است.
برخی نکات کاربردی که گر به این بیماری مبتلا هستید می توانید از آنها استفاده کنند:
- برای حفظ قدرت و انعطاف پذیری ورزش کنید. رژیم غذایی سالمی داشته باشید. قبل از شروع رژیم غذایی یا برنامه ورزشی جدید با پزشک خود مشورت کنید.
- در انجام فعالیت های بدنی زیاده روی نکنید ؛ محدودیت های خود را بشناسید و به آنها پایبند باشید.
- فرش ها و موانع کم ارتفاع را از مسیرهای داخل و خارج خانه خارج کنید.
- لباس هایی که دارای دکمه ها و زیپ های پیچیده هستند را با لباس هایی که می
- توانید به راحتی آنها را ببندید جایگزین کنید ، مانند شلوار کمر کش.
- کاشی دستشویی می تواند هنگام خیس شدن لغزنده و خطرناک شود. تعویض آن با موکت سرتاسری را در نظر بگیرید.
- در بلند کردن پاها و تکان دادن دست ها اغراق کنید. هر بار وانمود کنید که می خواهید از روی یک چوب عبور می کنید.
- لقمه های غذا را بسیار کوچک بردارید ، کاملاً بجوید و با دقت قورت دهید.
- قبل از شروع کردن به صحبت ، یک نفس بکشید و بین هر چند کلمه یا حتی بین هر کلمه مکث کنید.
- به جای نوشتن با دست ، از رایانه استفاده کنید.
داروها
چندین نوع دارو برای مدیریت پارکینسون وجود دارد. بسته به علائم خفیف یا پیشرفته ، ممکن است این داروها به تنهایی یا همراه با یکدیگر استفاده شوند.
- داروهایی که با جلوگیری از تجزیه MAO-B ، میزان دوپامین در مغز را حفظ می کنند. این داروها سلژیلین (Eldepryl , Zelapar ) و راساژیلین (Azilect) هستند که محافظ عصبی نیز بوده و می توانند پیشرفت بیماری را کند کنند.
- دارویی که نروترنسمیتر عصبی گلوتامات را متوقف می کند و باعث افزایش ترشح دوپامین می شود. این دارو آمانتادین (Symmetrel) است.
- داروهایی که مواردی را معرفی می کنند که نقش دوپامین را تقلید کرده و به گیرنده های سیناپس نورون متصل می شوند. این داروها شامل پرامیپکسول (Mirapex) و روپینیرول (Requip) و آپومورفین (Apokyn) هستند.
- داروهایی که دوپامین از دست رفته را در مغز جایگزین می کنند. لوودوپا به مشکلات حرکتی ناشی از لرزش ، سفتی ، کندی و راه رفتن کمک می کند. لوودوپا با کاربیدوپا (Sinemet) ترکیب می شود تا عوارض جانبی حالت تهوع را کاهش داده و اطمینان حاصل شود که لوودوپا در مغز به دوپامین تبدیل می شود نه در روده یا خون.
- داروهایی که با مسدود کردن COMT در مغز، که باعث تجزیه دوپامین در دستگاه گوارش می شود، ورود میزان ثابت لوادوپا به جریان خون را میسر می کند. این داروها شامل تولکاپون (Tasmar) و انتاکاپون (Comtan) هستند.
- داروهای کاهش دهنده فعالیت نروترنسمیتر استیل کولین. این داروها لرزش را کاهش می دهند و شامل تری هگسی فنیدیل (آرتان) و بنزتروپین (کوگنتین) می شوند.
پس از مدتی مصرف دارو ، بیماران ممکن است متوجه شوند که اثر هر دوز قبل از مصرف دوز بعدی از بین می رود یا نوسانات نامنظمی در اثرگذاری دارو وجود دارد. داروهای ضد پارکینسون می توانند باعث ایجاد دیسکینزی شوند ، حرکت ها و تکان های غیرمعمول که معمولاً در حداکثر دوز اتفاق می افتد و ناشی از بار زیاد داروهای دوپامین است. گاهی اوقات دیسکینزی می تواند مشکل تر از علائم پارکینسون باشد.
یک روش جدید برای مصرف دارو از طریق پمپ دارو است که ژل کاربیدوپا/لوودوپا (Duopa) را مستقیماً به روده ها می رساند. یک جراحی برای قرار دادن سوراخی کوچک (استوما) در معده لازم است که از طریق آن تیوبی به پمپ قابل حملی که روی کمربند پوشیده می شود متصل شود. این پمپ به گونه ای طراحی شده است که برای بهبود جذب و کاهش زمان های اضافی، دارو را به طور مداوم ، در دوز کم و پیوسته ، ، تزریق می کند. شبیه پمپ های انسولین است که توسط بیماران دیابتی استفاده می شود.
عمل جراحی
هنگامی که داروها به دلیل نوسانات شدید در اثربخشی ، عدم اثربخشی یا عوارض جانبی غیرقابل تحمل، نمی توانند علائم را کنترل کنند ، باید گزینه جراحی را در نظر گرفت. سایر روشهای جراحی شامل پالیدوتومی و تالاموتومی هستند که برای هدف قرار دادن گانگلیون های خاص برای تخریب یا تحریک انجام می شوند.
- تحریک عمیق مغزی (DBS) یک روش جراحی برای کاشت دستگاهی مانند ضربان ساز است که سیگنال های الکتریکی را به نواحی مغز که مسئول حرکت بدن هستند ارسال می کند. الکترودها بسته به علائم تحت درمان، در ناحیه خاصی از مغز (معمولاً هسته زیر تالاموس) قرار می گیرند. الکترودها در دو طرف چپ و راست مغز از طریق سوراخ های کوچکی که در بالای جمجمه ایجاد شده اند قرار می گیرند. الکترودها توسط سیمهای اکستنشن بلندی که از زیر پوست و پایین گردن عبور می کنند به یک استیمولاتور دارای باتری در زیر پوست سینه، متصل می شوند (شکل ۴). هنگامی که استیمولاتور روشن می شود ، پالس های الکتریکی را برای مسدود کردن سیگنال های عصبی معیوب ، که باعث لرزش ، سفتی و سایر علائم می شوند ارسال می کند.
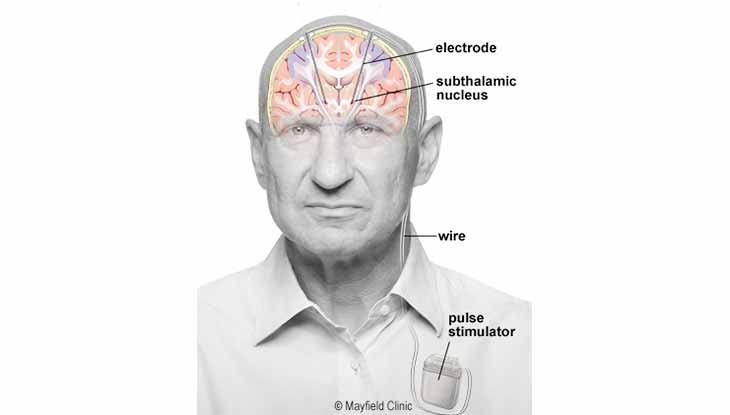
شکل ۴. مروری بر محرک عمیق مغزی . (DBS)الکترودها از طریق حفره های کوچکی در جمجمه در اعماق مغز قرار می گیرند. الکترودها توسط یک سیم بلند به یک استیمولاتور باتری دار متصل می شوند که در زیر پوست سینه قرار می گیرد. از آنجا که سمت چپ مغز سمت راست بدن را کنترل می کند و برعکس ، DBS معمولاً در هر دو طرف مغز انجام می شود. بیمار می تواند استیمولاتور را با کنترل دستی خاموش و روشن کند.
- تنظیمات استیمولاتور قابل برنامه ریزی است و با تغییر علائم شما در طول زمان قابل تنظیم است. DBS ، علائم کندی ، لرزش و سفتی را بهبود می بخشد. اکثر افراد می توانند داروهای خود را کاهش داده و عوارض جانبی آنها ، از جمله دیسکینزیا را کم کنند. علاوه بر این ، DBS به بافت مغز آسیب نمی رساند. بنابراین ، اگر درمانهای بهتری در آینده ایجاد شود ، روش DBS می تواند معکوس شود.
- سایر روشهای جراحی شامل پالیدوتومی و تالاموتومی است که مناطق خاصی از مغز را هدف قرار می دهد. اما به جای تحریک ، از یک جریان انرژی با فرکانس بالا برای تخریب دائمی سلول ها استفاده می کنند. این روش ها برگشت پذیر نیستند و فقط در موارد خاصی که به کار بردن DBS امکان پذیر نیست استفاده می شوند.
بیماران مبتلا به افسردگی شدید ، زوال عقل پیشرفته یا شرایط ناپایدار پزشکی، ممکن است کاندید جراحی نباشند. همچنین بیمارانی که علائم مشابه پارکینسون دارند اما اختلال متفاوتی مانند آتروفی سیستم چندگانه ، فلج پیشرونده هسته ای یا کورتیکوبازال دژنراسیون برایشان تشخیص داده شده است ، نباید تحت جراحی قرار گیرند.



